1 引言(Introduction)
生物炭是利用生物質殘體在缺氧環境中經過熱化學反應形成的富碳產物, 近年來因其潛在的固碳能力、土壤改良功能、污染物修復功能等而受到廣泛關注(Lehmann et al., 2015).人們通常于350~750 ℃溫度范圍內熱解制備生物炭, 并具有如下理化特征:比表面積約為10~600 m2·g-1, 大多為介孔結構, 孔內粗糙無序(Zhao et al., 2014);表面形成攜帶負電荷的官能團, 如羧基、酚/氫醌類物質等(Tsechansky et al., 2014);同時又富含礦物質, 如K、Ca、Mg、Fe、P等(Zhao et al., 2013b).利用生物炭修復廢水或土壤中的有機污染物, 人們的著眼點通常集中在生物炭的吸附效應, 并在這方面進行了大量的機理探索.已被證明的主要結合機制為疏水分配作用、孔隙填充作用及可能的電子作用, 包括p(孤對電子)/π-π、陽離子-π、電子供受體(EDA)及氫鍵和靜電吸附效應(Sun et al., 2012; Xu et al., 2017; Fu et al., 2018; Zhang et al., 2018b), 這些皆歸因于生物炭的芳香化結構、表面官能團和負電荷(Zhao et al., 2013a; Xiao et al., 2017).也有不少研究是將生物炭作為一種載體, 用以固定微生物菌體, 將其用于土壤有機污染物的修復過程中, 生物炭固定菌比僅采用游離菌更能耐受高濃度的有機污染物, 因而持續去除能力強(李巖, 2014).劉亮(2015)采用這種方法處理PAHs, 由稻殼生物炭(350 ℃)包埋菌獲得了最高31.3%的降解率.Xiong等(2017)和Ni等(2018)研究證明, 生物炭包埋菌在土壤中的確發揮了吸附和降解的雙重功效, 使得PAHs的降解率從單純使用游離細菌時的19.7%~47.3%提高到52.1%~62.6%.如若將生物炭添加到高濃度有機污染物廢水生物降解系統, 是否可以利用生物炭的特殊結構和功能促進高濃度污染物的降解, 這個問題值得探討.
苯酚污染廢水是一類常見的工業廢水, 污染濃度從50~1500 mg·L-1不等.現有的苯酚廢水處理技術主要有化學法(如催化降解)、物理法(如活性炭吸附)和生物降解法等(程雯等, 2018).例如, 吉芳英等(2018)采用介孔yolk-shell型Co3O4@mSiO2納米反應器處理苯酚廢水, 其處理的濃度在50 mg·L-1左右; 吳彥霞等(2017)采用類Fenton催化劑處理苯酚廢水, 其處理的濃度在100 mg·L-1左右.微生物降解技術能夠處理濃度較高的苯酚廢水, 但由于微生物對高毒性物質的耐受度有限, 因此, 常規的降解方法往往導致菌體生長受阻.師永健等(2013)采用移動床生物膜反應器可以將苯酚進水濃度從200 mg·L-1提高到1400 mg·L-1, 但工藝較為復雜; 魏霞等(2016)和張海濤等(2016)均采用分離、篩選并鑒定耐鹽高效苯酚降解菌的方式得到了特效菌株, 并分別對500 mg·L-1和800 mg·L-1的苯酚獲得了90%以上的降解率.但篩選特征菌畢竟需要較高的操作技術及保存條件, 因此, 亟需開發工藝簡潔、成本低廉的處理工藝.基于此, 本研究擬將生物炭作為一種添加材料, 加入到苯酚污染模擬廢水降解系統中, 考察生物炭是否對微生物生長及降解苯酚有促進作用, 是否可利于微生物耐受高濃度苯酚污染模擬廢水, 并闡明其機制.
2 材料與方法(Materials and methods)
2.1 實驗材料
2.1.1 生物炭制備與表征
所用生物炭采用花生殼制備, 為避免雜質影響, 先用自來水將其表面沖洗干凈, 再于60 ℃烘干.經粉碎、過篩(10目)后, 置于管式爐(GSL-1100X-6-S, 合肥科晶材料技術有限公司)中在氮氣氛圍下熱解.熱解程序為:以5 ℃·min-1升溫至100 ℃并保溫1 h, 使物料充分干燥; 再以10 ℃·min-1繼續升溫至350、550或750 ℃并維持2 h, 使其充分熱解.最后所得生物炭經球磨, 過200目標準篩后保存備用.
生物炭C、H、O、N含量由元素分析儀(vario EL cube, 德國Elementar Analysensysteme公司)測得.用比表面積分析儀(ASAP 2020 Plus, 美國Micromeritics Instrument公司)進行N2吸附(77 K), 在相對壓力為0.05~0.18之間應用Brunauer-Emmett-Teller(BET)方法計算生物炭比表面積.將生物炭在富氧、900 ℃下煅燒2 h, 測定其灰分含量.對生物炭消解后使用等離子發射光譜儀(5110 ICP-OES, 美國Agilent公司)測定礦物質含量.
2.1.2 苯酚降解菌的準備
所用苯酚降解菌Pseudomonas citronellolis購自中國農業微生物菌種保藏管理中心(編號ACCC 02839), 該菌為革蘭氏陰性, 好氧生長, 能以苯酚為唯一碳源和能源.
LB培養基:胰蛋白胨10 g·L-1, 酵母膏5 g·L-1, NaCl 10 g·L-1, pH調節為7.0, 經121 ℃高壓蒸汽滅菌20 min.固體培養基另加16 g·L-1瓊脂.
無機鹽培養基:KH2PO4 0.1 g·L-1, Na2HPO4 0.45 g·L-1, NH4Cl 0.3 g·L-1, MgSO4·7H2O 0.04 g·L-1, CaCl2 0.0045 g·L-1, 同樣高壓蒸汽滅菌后使用(Chen et al., 2013).
用于后續實驗接種的菌液采自培養對數期末期, 在清洗并重懸后, 其OD600=0.1.
2.1.3 生物炭-海藻酸鈣固定化微生物的制備
在含有600 mg·L-1苯酚的無機鹽培養基中添加6 g·L-1熱解(550 ℃)生物炭, 接種苯酚降解菌后培養48 h.之后用5 μm濾膜真空抽濾截留吸附有微生物的生物炭, 生理鹽水沖洗后重懸得到0.1 g·mL-1懸濁液.將此懸濁液以一定比例混合于海藻酸鈉水溶液中, 并在40 ℃恒溫水浴中磁力攪拌均勻, 然后用蠕動泵以適當流速使其滴入2% CaCl2溶液中.形成的生物炭-海藻酸鈣小球繼續靜置0.5 h后經生理鹽水沖洗, 即可于4 ℃保存備用.所有操作在無菌環境下進行.
2.2 實驗方法2.2.1 苯酚降解菌對不同濃度苯酚的降解
使用加有不同濃度苯酚的無機鹽培養基培養該菌, 以了解其苯酚降解性能.用菌液按4%接種量接種到100 mL含苯酚無機鹽培養基中, 苯酚濃度分別設定為110、220、420 mg·L-1.接種后的培養液在30 ℃、160 r·min-1條件下培養, 每隔幾小時取樣1 mL, 分成兩份, 分別測定OD600值和苯酚濃度.
OD600值使用酶標儀(Multiskan FC, 美國Thermo Fisher公司)于600 nm波長處測定200 μL樣品吸光度, 以無機鹽培養基為零點.
苯酚濃度使用高效液相色譜(Breeze HPLC, 美國Waters公司)測定.將所取樣品于12000 r·min-1離心10 min后, 取上清液過0.22 μm濾膜, 然后用乙腈稀釋一定倍數后待測.色譜條件:色譜柱為C18反相硅膠柱, 進樣量20 μL, 流動相為乙腈:水=6:4, 流速0.8 mL·min-1, 波長280 nm.
2.2.2 生物炭對微生物降解苯酚的影響
在考察不同生物炭添加量對微生物降解苯酚的影響時, 向含有430 mg·L-1苯酚的無機鹽培養基中分別添加2、4和6 g·L-1的550 ℃熱解生物炭.由于生物炭略顯堿性, 故使用適量0.2 mol·L-1鹽酸調節初始pH到7.0.接種后按照上述培養條件在搖床上培養, 隔一定時間取樣測定液相中苯酚濃度, 并在實驗結束后測定體系pH值.另外設置不接種微生物的對照組來考察生物炭對苯酚的吸附作用.
進行生物炭負載微生物的形態觀察所需樣品取自實驗32 h后, 為已確定液相中苯酚被完全去除的樣品.在經生理鹽水清洗、2%戊二醛于4 ℃固定2 h、乙醇梯度脫水、CO2臨界點干燥和噴金等處理后, 用掃描電鏡(TESCAN GAIA3, 捷克TESCAN公司)進行形態觀察(Song et al., 2005).
將不同熱解溫度(350、550、750 ℃)制備的生物炭按6 g·L-1的比例添加到無機鹽培養基中, 苯酚濃度提高到800 mg·L-1, 同樣調節初始pH值, 接種后在上述同樣條件下培養.每隔一段時間取樣, 測定苯酚濃度的同時, 跟蹤體系pH值的變化.
生物炭對微生物降解苯酚的促進作用可能受限于苯酚的初始濃度.將上述制得的吸附有微生物的生物炭按2 g·L-1的比例添加到含有更高苯酚濃度(600~1200 mg·L-1)的無機鹽培養基中, 并與未添加生物炭的游離微生物組進行對照.同樣搖床培養, 一定時間后取樣, 測水相中苯酚濃度.
2.2.3 生物炭-海藻酸鈣固定化對微生物降解苯酚的影響
將生物炭-海藻酸鈣固定化微生物小球按2 g·L-1 (以生物炭量計)的比例添加到含苯酚(600~1200 mg·L-1)的無機鹽培養基中, 并用僅海藻酸鈣固定(無生物炭)的微生物作為對照, 其余操作同上.
2.3 數據分析
苯酚去除率按照式(1)計算, 所有實驗均做3個平行樣, 采用Excel2016及Originlab9.0進行標準偏差分析與作圖, SPSS23.0進行單因素ANOVA差異性檢驗(p < 0.05).
式中, η為苯酚去除率, Ct為t時刻液相中苯酚濃度(mg·L-1), C0為苯酚添加初始濃度(mg·L-1).
3 結果與討論(Results and discussion)3.1 不同初始濃度苯酚的微生物降解效果
在未添加生物炭的情況下, 首先研究了不同初始濃度苯酚對微生物生長的影響及微生物降解苯酚的效果.由圖 1可知, 在初始苯酚濃度為110~420 mg·L-1的模擬廢水中, 微生物的生長曲線都為典型的“S”形, 即按照時間呈現出滯后期、對數期和穩定期的生長趨勢.但隨著苯酚濃度的升高, 微生物在對數期的生長速率逐漸降低, 說明相對較高的苯酚濃度對微生物生長有明顯的抑制效應.但苯酚對微生物既有毒性效應, 也是“營養食物”, 在苯酚濃度為110 mg·L-1的模擬廢水系統中, 微生物生長速率最快, 但其最終達到的菌濃度(OD600=0.06)卻明顯低于苯酚濃度為220、420 mg·L-1的系統, 說明此苯酚濃度不能滿足微生物生長的營養需要.但苯酚濃度為420 mg·L-1時, 并沒有使菌的最終濃度超過220 mg·L-1系統, 說明此時微生物已經達到了最大生長極限, 苯酚濃度的提高并不能繼續被微生物所利用.
圖 1
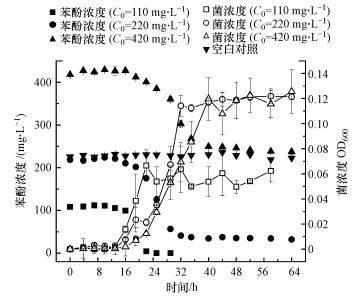
圖 1微生物在不同濃度苯酚下的生長及對苯酚的降解(空白對照僅針對220 mg·L-1苯酚濃度, 不接種微生物)
微生物的生長伴隨著系統中苯酚濃度的降低, 兩者在時間上有較強的一致性(圖 1).微生物處于對數生長期時, 苯酚的降解速度也最快, 在微生物生長達到穩定期后, 苯酚的濃度也不再下降.除了初始濃度為110 mg·L-1的苯酚被完全降解外, 220 mg·L-1和420 mg·L-1的苯酚均未被完全降解, 且苯酚濃度越高, 剩余越多.高濃度的苯酚雖然提供了充足的代謝底物, 但苯酚的毒性也會隨之增強, 最終抑制微生物對其的進一步利用(Nuhoglu et al., 2005).
3.2 不同生物炭添加量對微生物降解苯酚的影響
選取初始濃度為430 mg·L-1的苯酚污染模擬廢水, 將550 ℃條件下熱解制備的花生殼生物炭按照2、4和6 g·L-1的比例添加到系統中, 并與微生物共培養, 得到苯酚降解曲線(圖 2a)及pH變化曲線(圖 2b).與3.1節結果一致, 單獨微生物菌體仍未能完全降解苯酚, 其降解率為36.3%.而添加了生物炭的系統中, 苯酚的去除率有大幅提高.在0~6 h內, 生物炭促進苯酚濃度快速降低(去除率為12.0%~39.3%), 且這種降低效應與生物炭添加量明顯成正比, 說明該時間段內的去除機制主要為生物炭的吸附作用.在6~16 h內, 添加生物炭的系統中苯酚濃度快速降低, 表明微生物進入對數生長期.3種添加比均可使苯酚在16 h之內被微生物降解完全, 去除率達到100%.而單獨微生物存在的系統中, 微生物生長緩慢, 在第16~25 h的對數生長期, 由于苯酚毒性的抑制, 其最高降解率僅為38.2%.生物炭添加量增大意味著其吸附了更多的苯酚, 這使得溶液中的苯酚濃度降低, 從而減少了對微生物的毒性抑制.另外, 更多的生物炭能夠提供更多的供微生物吸附的表面, 從而使微生物的生物量能夠達到更大值(Pietikainen et al., 2000).因此, 在本系統中, 生物炭作為微生物的載體作用效果顯著.
圖 2
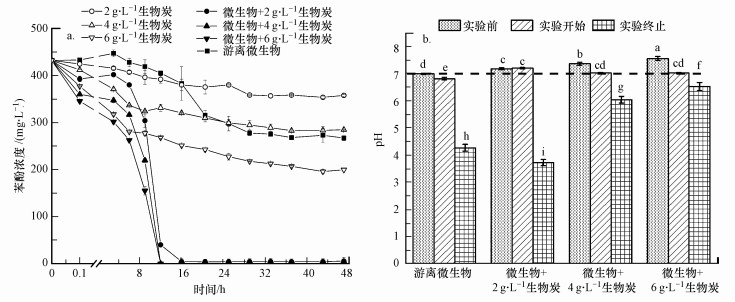
圖 2不同生物炭添加量對微生物降解苯酚(a)及體系pH(b)的影響
通過測定實驗開始前和終止后的溶液pH, 發現添加550 ℃熱解生物炭的系統呈堿性, 其添加量越多, 培養液pH升高越多, 最大能達到7.58.在實驗開始時, 用適量的鹽酸調節pH, 使其在7.0左右, 有利于微生物的生長.實驗結束后, 游離微生物實驗組pH降低到4.27, 而添加2 g·L-1生物炭的實驗組則降低到3.74.結合之前的實驗可以推測出, 由于添加2 g·L-1的生物炭, 苯酚被完全降解, 因而產生了比游離微生物組更多的酸性中間產物, 少量的生物炭又不足以中和其酸性, 因此, 其溶液pH最低(Santos et al., 2007).隨著生物炭添加量的增多, 溶液pH又逐漸變大.
為了驗證生物炭的吸附作用能夠去除的苯酚量, 進行了單獨添加生物炭而不接種微生物的無菌環境下的苯酚吸附實驗(圖 2a).由圖可知, 2、4和6 g·L-1的生物炭添加量分別獲得了17.2%、34.1%和53.8%的苯酚去除率, 去除率與添加量成正比, 表明單純依靠生物炭的吸附作用去除苯酚, 效果遠低于吸附作用結合微生物的降解作用.
3.3 不同熱解溫度生物炭對微生物降解苯酚的影響
上述研究表明, 生物炭添加可以顯著促進微生物降解苯酚, 其機制涉及生物炭的吸附和pH緩沖能力等.為了進一步深入研究生物炭的多重作用機制, 本研究選取更高濃度(800 mg·L-1)的苯酚污染模擬廢水, 采用不同溫度下(350、550和750 ℃)制備的生物炭, 按6 g·L-1的比例添加到苯酚降解系統中, 得到圖 3所示的降解曲線.由圖 3可知, 350 ℃熱解溫度制備的生物炭, 其吸附作用低于550 ℃、750 ℃熱解溫度制備的生物炭, 后兩者之間的吸附作用相差不大.由表 1可知, 350 ℃熱解溫度制備的生物炭的比表面積(11 m2·g-1)比另外兩種生物炭(143 m2·g-1和304 m2·g-1)低很多, 但其吸附作用并沒有表現出巨大差異, 這是因為生物炭對苯酚的吸附作用不僅受比表面積的影響, 還會受分配作用的影響, 低溫生物炭由于具有更多的表面含氧官能團和脂肪碳而表現出更明顯的分配作用(Chen et al., 2008; Zhang et al., 2018a).
圖 3
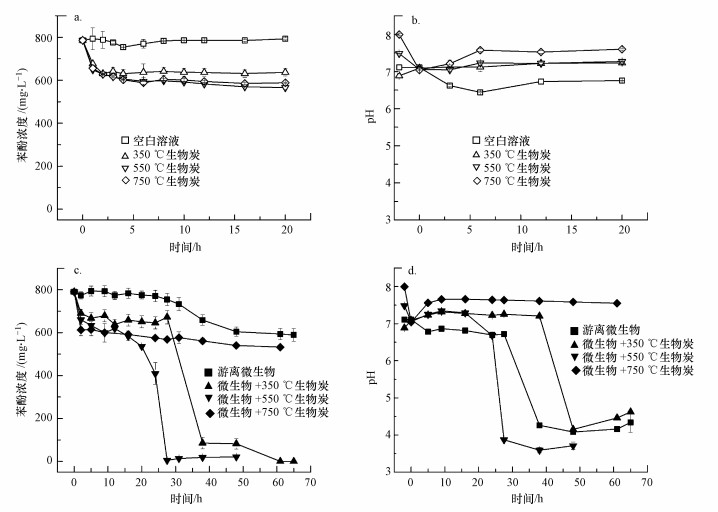
圖 3不同熱解溫度生物炭對苯酚的吸附對照(a.苯酚濃度, b.pH變化)及不同熱解溫度生物炭對微生物降解苯酚(c)及pH變化(d)的影響
表 1 生物炭的基本性質
3種生物炭對于微生物進入對數生長期開始降解苯酚的過程表現出顯著的差異.游離微生物仍具有一定的降解能力, 其最終降解率約為25.4%.550 ℃下制備的生物炭表現出最高的強化作用, 使微生物進入對數生長期的時間(約在20 h左右)大大提前; 350 ℃下制備的生物炭也表現出較好的促進作用, 其微生物進入對數生長期的時間約在27 h; 但750 ℃下制備的生物炭對微生物生長表現出了抑制作用, 除了約25%的吸附去除外, 未能使微生物正常生長.這可能是高溫下制備的生物炭具有較強的堿性(本體pH達11.24, 在此體系中溶液pH短時間內回升到7.6以上), 以致實驗開始時接種的少量微生物未能存活, 說明該苯酚降解菌對堿性pH有較高的敏感性.具體聯系污水寶或參見http://m.bnynw.com更多相關技術文檔。
實驗所用假單胞菌Pseudomonas citronellolis對苯酚的降解為鄰位開環路徑, 主要生成一些如順, 順-已二烯二酸、β-酮酯、琥珀酸等小分子有機酸(Santos et al., 2007;陳軍, 2017).在菌體的對數生長期, 酸性中間產物迅速累積, 造成pH快速降低, 最低到4以下, 反過來抑制菌體的生長, 使苯酚降解出現停滯.如果在pH降低到微生物能承受的最低限度之前, 苯酚尚未被完全降解, 那么在pH降低到此最低限度值后, 剩余的苯酚將不再能被微生物降解掉.因此, 具有更好pH緩沖能力的材料能夠解除這種酸性抑制作用.相比于常規的活性炭等材料, 生物炭通常呈堿性, 其pH隨熱解溫度的升高而升高.這一方面是因為生物質原料中的原生生物酸在熱解過程中不斷分解(Jeffrey et al., 2009);另一方面是因為隨著熱解溫度的升高, 生物炭產率下降, 而其所含的無機礦物難以揮發并逐漸累積(Braadbaart et al., 2008; Gaskin et al., 2008).生物炭堿性來源, 其無機體系主要是堿性礦物質,如CaCO3或Na、K、Mg等堿金屬和堿土金屬鹽類, 這在Zhao等(2013b)及本研究的表 1中均有呈現.Yuan等(2011)在其研究中證實, 由某些生物質所制的700 ℃生物炭, 其所含碳酸鹽類礦物能夠貢獻高達55%的堿度.另外, 有機體系如生物炭表面官能團—O-、—COO-等亦有較大貢獻.在苯酚降解過程中, H+被生物炭中的堿性組分中和, 在更大酸性中間產物濃度范圍內維持了pH的相對穩定, 從而保障了微生物的活性和降解速率.
3.4 生物炭對高濃度苯酚降解的影響
為了進一步驗證本系統中生物炭對微生物的載體作用和pH緩沖作用, 采用了更高的苯酚初始濃度進行對比.由圖 4可知, 當苯酚初始濃度為600和800 mg·L-1時, 未加生物炭的系統中微生物經歷了12 h的停滯期后開始降解苯酚, 最終降解率約25%.但當初始濃度高達1000和1200 mg·L-1時, 其毒性效應使微生物難以存活, 苯酚未得到任何降解.然而, 添加2 g·L-1的吸附有微生物的生物炭, 可將4種濃度的苯酚去除率明顯提高到46.9%、36.9%、35.1%和33.7%.在苯酚濃度升高的前提下, 其降解率卻保持了相當的穩定性, 只是微生物的降解速率有較明顯的減慢.這進一步證實了生物炭對于苯酚降解菌的保護作用, 使其對高濃度的苯酚具有了較強的耐受力(Du et al., 2016).
圖 4
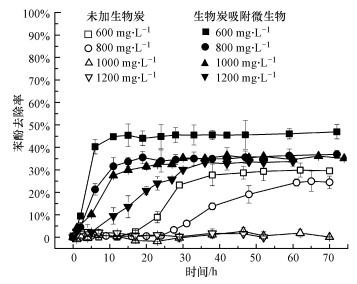
圖 4生物炭添加對高濃度苯酚污染模擬廢水中微生物降解效果的影響
3.5 生物炭凝膠固定微生物對高濃度苯酚降解的影響
通過簡單的生物炭吸附負載微生物, 可以在400~800 mg·L-1的濃度范圍內大大促進模擬廢水中苯酚的降解, 但如果濃度繼續升高, 盡管有生物炭的輔助作用, 微生物仍難以抵抗高濃度苯酚的毒害作用.因此, 本文擬采用海藻酸鈣凝膠固定化方法將微生物包埋固定于生物炭之上, 驗證其對苯酚降解的作用效果.生物炭-海藻酸鈣凝膠固定微生物小球呈黑色, 柔軟具有彈性; 其平均直徑為3.6 mm, 每個小球中生物炭含量約為3.2%.由圖 5可知, 生物炭-海藻酸鈣凝膠固定微生物明顯表現出對高濃度苯酚更強的耐受性.在600 mg·L-1苯酚濃度下, 降解率達到100%, 遠遠高于未加生物炭, 以及未凝膠固定化的情況.對比單純采用游離微生物制作的凝膠固定化小球與以生物炭作為載體的凝膠固定化小球的降解效果, 發現當苯酚濃度達到1200 mg·L-1時, 前者沒有表現出降解作用, 僅有些許降低是因為凝膠小球對苯酚的吸附作用, 而后者則表現出了62.5%的降解率.觀察未加生物炭制備的凝膠固定小球顏色, 發現其在較低濃度下變成灰白色, 微生物有顯著生長, 但在極端高濃度下, 顏色未變化, 說明菌體未發生生長.另外, 在較低濃度的苯酚下, 生物炭-海藻酸鈣凝膠固定微生物對苯酚的降解速率要高于單純海藻酸鈣凝膠固定微生物.固定化過程中, 海藻酸鈉中的古羅糖醛酸陰離子與Ca2+絡合形成疏水性離子交聯結構, 將微生物限制在一個個“網格”之中, 從而起到保護菌體免受外部環境沖擊的作用(Cassidy et al., 1996;陳益清, 2018).但這樣一種結構亦是一把“雙刃劍”, 其負面效應即是會明顯阻礙氧、營養物及有機污染物向微生物的傳質, 從而降低其降解速率(Cassidy et al., 1996; Banerjee et al., 2011).隨著表面粗糙多孔的生物炭的加入, 凝膠小球的孔隙勢必會有明顯增大, 因而傳質阻礙得到一定程度的緩解.另一方面, 前文所述生物炭的pH緩沖作用及對苯酚的吸附固定, 進一步減輕了高濃度苯酚對微生物的毒性脅迫, 體現了其保護作用.
圖 5
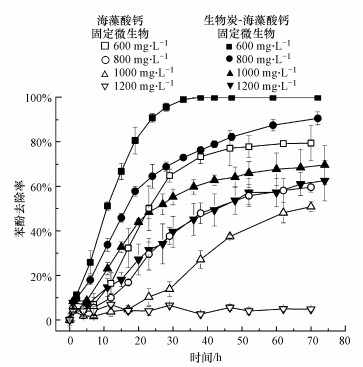
圖 5不同濃度苯酚下生物炭-海藻酸鈣固定微生物對苯酚的降解效果
3.6 生物炭的性質及負載微生物的微觀形態
為了研究生物炭添加對于強化模擬廢水中高濃度苯酚的降解效果的機理, 對生物炭的基礎性質包括元素分析、礦物質組分和比表面積進行了測試.由表 1可見, 隨著熱解溫度的升高, 得到的生物炭產物含C量增高, 而O、H和N含量降低.生物炭的pH顯著升高, 當熱解溫度為750 ℃時, 生物炭pH高達11.24, 呈強堿性, 因而導致微生物生長受到抑制, 系統失去對苯酚的降解能力.而熱解溫度為350 ℃時, 其生物炭堿度較低, 難以緩沖高濃度苯酚降解過程中產生的大量酸性中間產物.生物炭比表面積隨著溫度升高而顯著增加, 3種溫度下的生物炭比表面積分別為11、143和304 m2·g-1, 并且主要是孔徑為2~30 nm的介孔, 而微孔不夠發達(Zhao et al., 2014), 這樣的物理結構對有機污染物具有一定的吸附能力, 能夠使菌體附著其上, 但又不至于像活性炭這樣的高比表面積材料, 對污染物吸附能力過強, 導致其反而降低了污染物生物可利用性(Li et al., 2018; Sigmund et al., 2018).從掃描電鏡圖中也可以很明顯看到微生物菌體不僅可以附著在生物炭的孔徑內部, 也在其表面大量附著(圖 6).因此, 生物炭可作為微生物良好的載體, 提高微生物抵御高濃度苯酚的能力.
圖 6

圖 6菌體附著于生物炭之上的表面形態掃描電鏡圖(a.放大65000倍; b.放大10000倍)
4 結論(Conclusions)
1) 苯酚對于降解菌既是一種抑制菌體活性的毒性物質, 又是菌體賴以生存的代謝物.苯酚濃度過低(≤110 mg·L-1)時不能使菌體達到最大濃度, 過高(≥420 mg·L-1)則使菌體生長受抑制, 難以達到高效的降解效果.生物炭的添加具有一定的吸附效應, 可以將初始苯酚濃度部分降低, 縮短微生物停滯期, 快速進入對數生長期, 產生高效降解.
2) 生物炭的堿度較大, 中溫(500 ℃左右)條件下制備的生物炭具有較高的pH, 能夠對苯酚降解過程中產生的酸性中間產物起到中和作用, 給微生物的生長提供較適pH, 大大提高其降解能力.但過高溫度(700 ℃左右)制備的生物炭pH過高(>10.0), 反而不利于微生物的生長.
3) 通過海藻酸鈣凝膠將菌體固定在生物炭之上, 制成包埋小球, 可以大大提高菌體耐受高濃度苯酚(1200 mg·L-1)的能力, 降解率也大大提升.這主要是因為凝膠小球內苯酚的傳質減慢, 微生物直接接觸的苯酚濃度降低.生物炭-海藻酸鈣凝膠固定微生物的降解效率要顯著高于單獨海藻酸鈣固定的微生物.(來源:環境科學學報 作者:肖冬林)



